前記事で、腸管出血性大腸菌(EHEC)の自然宿主はウシなどの反芻動物であり、いっぽう残りの4つの下痢性大腸菌(EPEC、ETEC、EAEC、EIEC)はヒトに適応した系統であると説明した。すると読者から、こんな質問が届いた。
「どうしてEHECだけがウシが自然宿主で、他の4つは人間が自然宿主なんですか?」
これはとても興味深い質問である。食品微生物学を学ぶ者にとって、時には微生物を単なる“敵”としてだけでなく、“進化の時間軸”における生態学的な位置づけを考えることも重要だ。ここでは細かい病原メカニズムではなく、生態と進化の時間軸から、この問いを捉え直してみたい。
※ 一部の非典型的EPEC(aEPEC)はウシなどの動物にも存在することが知られているが、主要な宿主がヒトである。
※ EHECは主にウシに関連しているが、ヒツジやシカなど他の反芻動物も保菌源となりうる。
進化の時間軸から見れば「牛にいる」のは当たり前
生命38億年の歴史を1年に圧縮すると、その起源は1月1日。
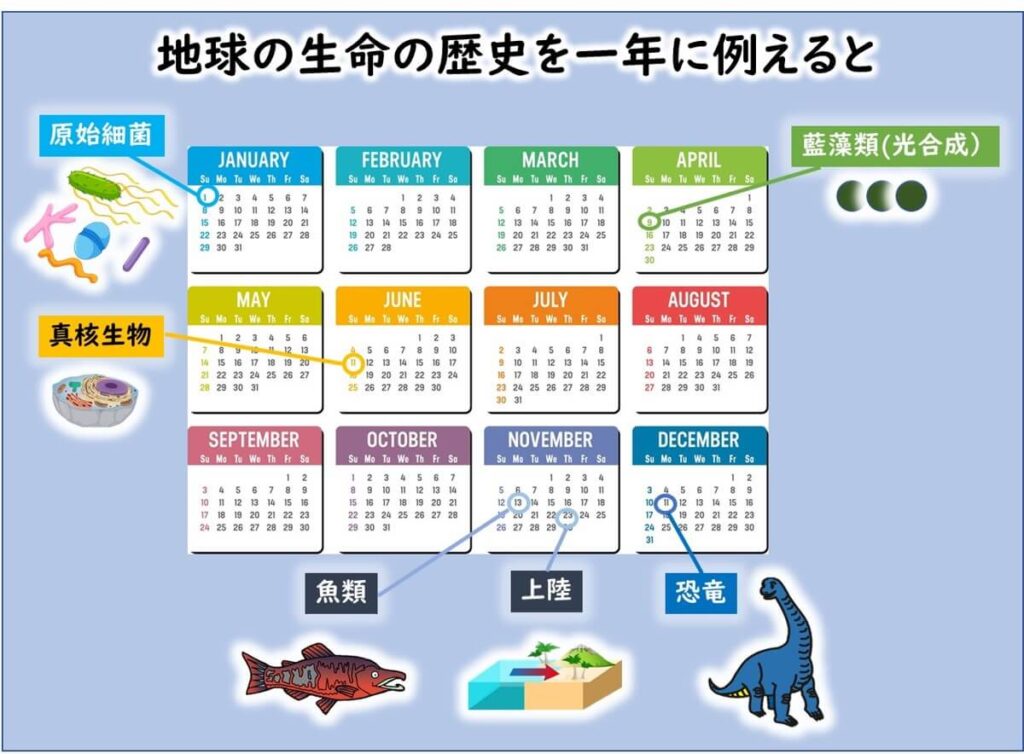
牛や豚といった哺乳類の祖先が登場するのは12月25日ごろである。そしてヒト(現生人類)が登場するのは、12月31日の夜21時ごろ。
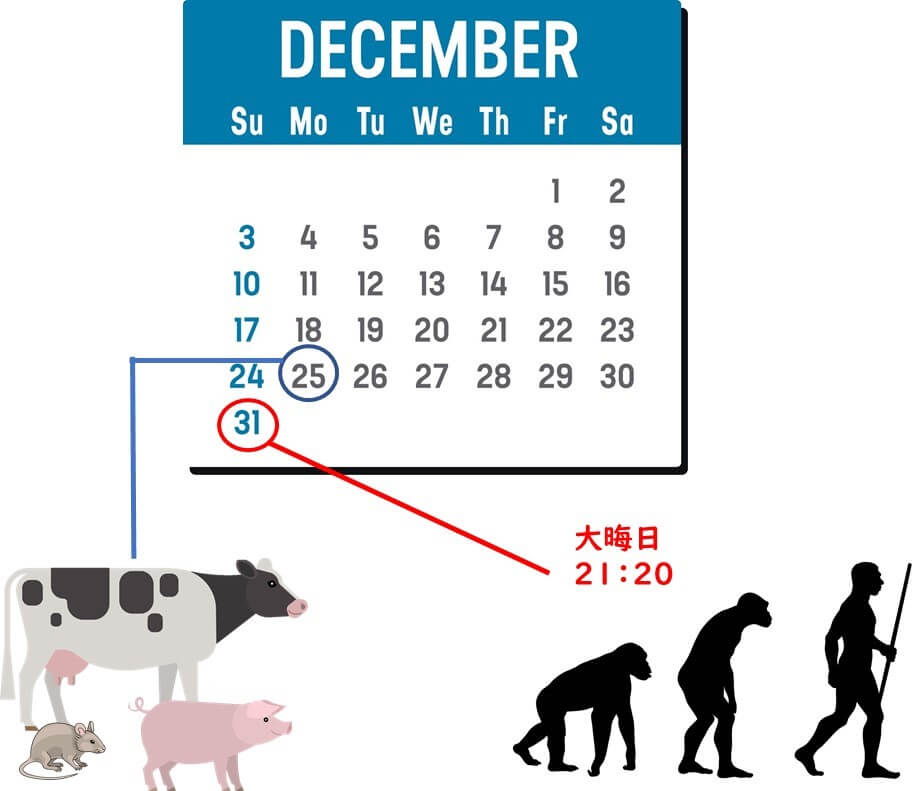
この時間差を踏まえると、大腸菌の祖先的な系統は、哺乳類の腸内に早い段階から共生してきたと考えられる。人類の出現以前から、ウシやブタなどの腸内に多様な大腸菌集団が存在しており、ヒトは比較的最近になってそれらを新しい宿主として取り込んだとみなすことができる。
大腸菌はもともと多様な“群れ”だった
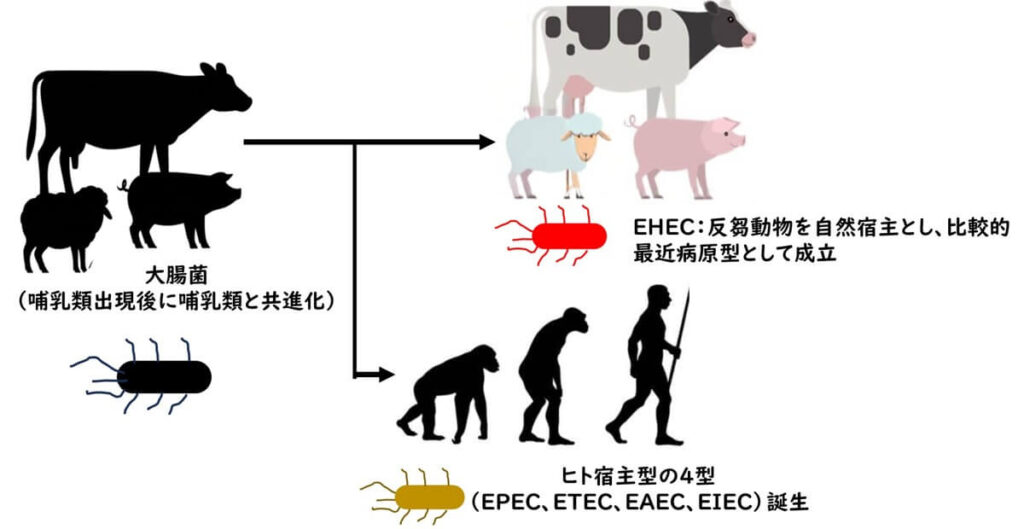
大腸菌は哺乳類出現後—哺乳類が存在する以前ではなく—に哺乳類と共進化したと考えられている。すなわち、原始細菌の歴史を1年に例えると、12月25日頃に誕生した新しい細菌といえる。大腸菌に類似した生物の初期祖先は、他の生態的地位(例:温血脊椎動物)に生息していた可能性が高いが、37°Cという高い体温をもつ哺乳動物の温かい腸内環境との共生関係は、哺乳類出現後に安定化したと考えられる。
ひとくちに、Escherichia coli(大腸菌)といっても、腸内には無数の系統が存在し、その多くは病原性を示さず、宿主と共存している。遺伝的には数十万年にわたる多様な分岐を経ており、その中の一部が毒素や付着因子を獲得し、病原株としてヒトにとって問題になるに過ぎない。EHECもその多様な“群れ”の中の一系統にすぎない。
ヒト宿主型の4型は「新参者」
哺乳類とともに共進化した大腸菌の中でも、EPEC、ETEC、EAEC、EIECの4型はヒトの腸内に適応した比較的新しいクローンである。ゲノム解析の結果、これらの型はヒトの登場後、あるいはヒト社会の形成(水・衛生環境、家畜化、人口密集など)に伴って拡大したと考えられている。例えば、主要なETECクローンの一部は数百年から数千年程度の比較的新しい分岐である可能性が示唆されており(von Mentzer ら(2014))、ヒト社会の拡大と衛生環境の変化に強く関連している。これは、ヒト宿主型大腸菌株の成立がきわめて近代に起きたことを示す代表的な知見である。
つまり、これら4型こそ特殊な存在であり、“ヒトという新しい宿主”に適応した新参者とみなすことができる。

※EPEC(腸管病原性大腸菌):腸上皮細胞に付着して微絨毛を破壊し、下痢を引き起こす。
ETEC(腸管毒素原性大腸菌):腸管内で毒素(LT・ST)を産生し、水様性下痢を引き起こす。
EAEC(腸管凝集付着性大腸菌):腸上皮に「レンガ状」に凝集して付着し、持続性の下痢を起こす。
EIEC(腸管侵入性大腸菌):腸上皮細胞内に侵入し、赤痢に類似した症状を示す。
では、腸管出血性大腸菌(EHEC)はいつ誕生したのか?
現代の主流な学説では、EHECは“ヒトの出現以前から続く”反芻動物の腸内という在来ニッチ(生物が適応して生息する環境)で成立したと整理される。ただし、成立した“時期”は比較的最近の出来事であり、EPEC O55:H7 に近縁な祖先株が反芻動物腸内でバクテリオファージを介して志賀毒素(Stx)遺伝子を獲得したことで、現在の病原型が生まれたと考えられている(例:Whittam 1993; Feng 1998; Ogura 2009)。
要するに、EHECという病原型の成立はヒト誕生以降の比較的新しい出来事であるものの、在来の生態ニッチは反芻動物であり、反芻動物の腸内環境で病原型として確立した。
まとめると次のようになる。
- 大腸菌全体の多様性: 様々な哺乳類の腸内に古くから存在
- 病原型の出現: 特定の病原因子獲得により病原化(比較的最近)
- 宿主特異性の違い:
- EHEC: 反芻動物の腸内環境で病原型として成立
- 他の4型: ヒトの腸内環境・社会環境で病原型として成立
すなわち、 EHECは在来宿主である反芻動物の腸内で成立した動物由来(ズーノーシス型)の病原体であり、ヒトに特化した腸管系下痢原性大腸菌4型とは進化の方向性が異なる。
なぜEHECはヒトで重症化するのか
なお、では、なぜ牛の腸内で進化した腸管出血性大腸菌(EHEC)が、人の腸内に入ると重篤な症状を引き起こすのか。この問いは、感染生態学・宿主―病原体相互作用の一般論として整理できるかもしれない。
微生物が本来の宿主以外と遭遇した場合、多くは定着できずに排除されるか、あるいは逆に、微生物側が宿主に対して過剰な攻撃を仕掛け、宿主に深刻なダメージを与える。このように、適応していない宿主に感染した際に、病原体の攻撃性が宿主側の適応を上回る現象は、一般に「病原性の過剰表出」あるいは「宿主―病原体バランスの破綻」として理解されている。これはvirulence–transmission trade-off仮説の文脈で説明できる(Alizonら、(2009))。

こうした現象はEHECに特有の話ではない。たとえば、エボラウイルスは本来の宿主であるコウモリでは症状をほとんど示さないが、人に感染すると極めて高い致死率を示す。また、2019年に出現した新型コロナウイルスでも、宿主とウイルスの共進化が進んでいない初期段階では病原性が高く、不安定な感染動態を示した。いずれも、「本来の宿主ではない」相手に感染したときに、病原体と宿主の間にバランスがないために起こる現象である。EHECもこれと同じ構図にあり、牛では無症状でもヒトでは重篤な症状を引き起こす理由を、この一般的なメカニズムで説明できる可能性がある。

おわりに ― 視点の逆転が洞察を生む
食品微生物学では、病原微生物の細部の特性に目をむけることが多いが、たまには、人間中心の視点から、微生物や地球、生命の歴史という地球生態学的な視点から捉えておくことも、重要である。細部のメカニズムを追うだけでは見えなかったことも、進化と生態の大きな視点で眺めると一気に立体的に理解できる。こうした視点の逆転が、感染症や微生物との共生関係を理解するうえでの本質的な洞察を与えてくれる。


