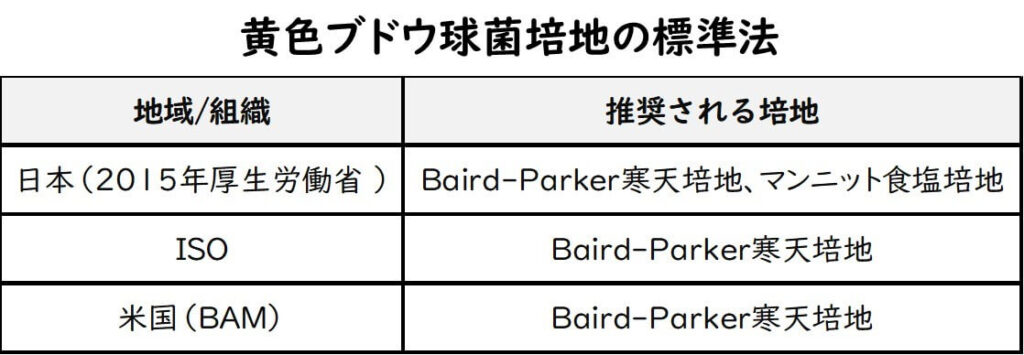
黄色ブドウ球菌の検査において、日本は長年、卵黄加マンニット食塩培地を主流としていた。一方、国際基準ではBaird-Parker寒天培地が推奨されていた。2015年、日本はBaird-Parker寒天培地を公式に採用し、国際標準化へと舵を切ったが、卵黄加マンニット食塩培地は依然として代替法として広く使用されている。この記事では、これらの培地の原理を初学者にも理解しやすく解説する。
二つの培地の歴史と国際的な使用状況
黄色ブドウ球菌の特定と成長に用いられる二つの重要な培地はマンニット食塩培地とBaird-Parker寒天培地である。マンニット塩培地(チャップマン培地)は、1930年代から1940年代にかけて、ニューヨークのClinical Research Laboratoryのジョージ・チャップマンとその共同研究者によって開発された。一方、Baird-Parker寒天培地は、1962年にUnilever Research Laboratory英国のベアード・パーカーによって開発された。
国際的には、ISO規格(ISO 6888-1:1999)や米国基準(BAM法)において、Baird-Parker寒天培地が推奨されてきた。これは、その高い特異性と信頼性によるものだ。マンニット食塩培地は、ISOやBAMでは記載されていない。
一方、日本国内では、長らく、卵黄加マンニット食塩培地が公定法だった。しかし、 2015年にBaird-Parker寒天培地を公式に採用し、国際標準化に舵を切った。

ただし、旧試験法の卵黄加マンニット食塩培地も代替法として使用可となっている。
食中毒菌を検出するための培地を用いる際には、その培地が特定の食中毒菌を選択的に増殖させ、識別する原理を理解することは基本である。

マンニット食塩培地
特定の微生物のみを増殖させる選択培地においては、基本的に1)選択の原理、2)識別の原理の組み合わせで行う。
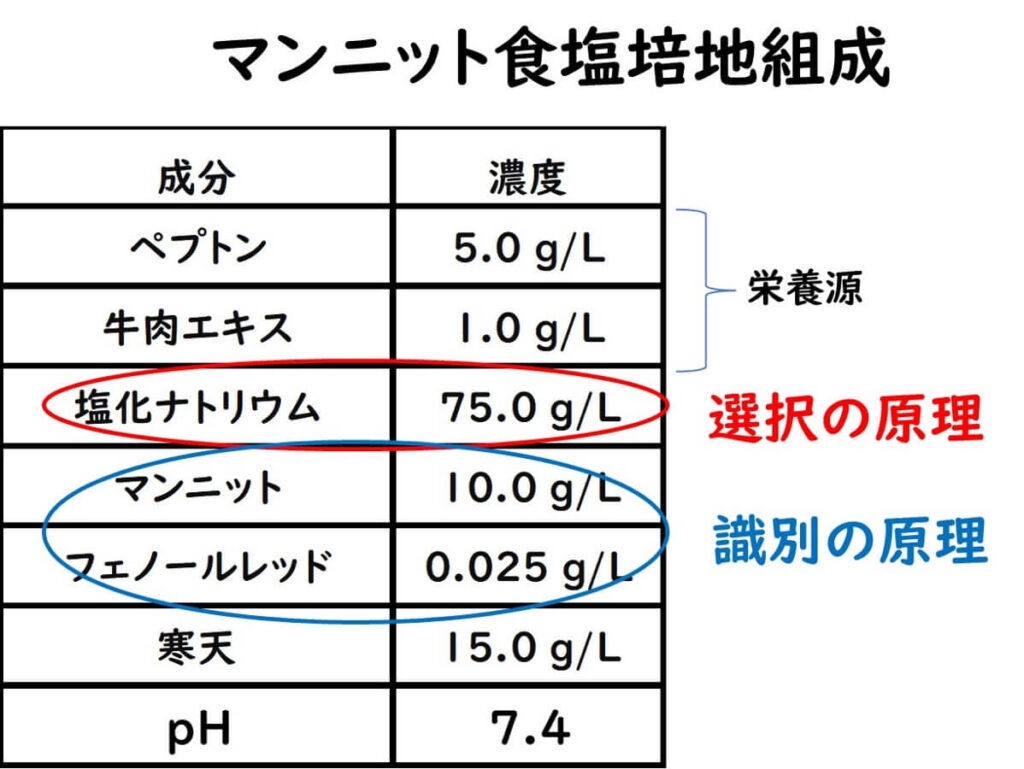
注)これらの成分は基本的な構成を示しているが、特定の実験や研究の要件に応じて、成分の比率が調整されることがある。また、同一成分であっても異なるメーカーによる製品の性質には差があるため、培地の調製においてはこれを考慮する必要がある。
選択の原理(高濃度食塩)
黄色ブドウ球菌は、細菌の中で特に高濃度の塩分に対して強い耐性を持っている。これは、黄色ブドウ球菌が哺乳動物の表皮に生息しており、汗の蒸発によって生じる塩分濃度の増加に適応しているためだ。黄色ブドウ球菌は7.5%の食塩濃度でも増殖できる。海水の塩分濃度が平均して約3.5%なので海水の2倍以上の塩分濃度であるということが分かる。この塩分濃度では、一部のバチルス属(Bacillus cereus など)、ミクロコッカス属(Micrococcus luteusなど)、腸球菌(Enterococcus faecalis)なども限定的に増殖する場合もある。
黄色ブドウ球菌の生態に関する基礎事項を確認したい方は、下記の記事をご覧ください。
識別の原理(マンニットの利用性)
表皮ブドウ球菌(Staphylococcus属)は黄色ブドウ球菌以外のブドウ球菌の総称であり、現在、40種以上が記載されいる。これらは黄色ブドウ球菌同様に皮膚に生息するが、基本的には無害な細菌である(免疫系が弱っている人や、外科的手術後などの特定の条件下では、感染症の原因となることがある)。S. epidermidis, S. hominis, S. capitis, S. haemolyticus, , S. warneri, S. lugdunensis, S. simulansなど、その他多くの種が知られている。
黄色ブドウ球菌をこれらの類縁菌から識別するためには、マンニット(マンニトール)の利用性が鍵となる。
マンニット(マンニトール)とは?
マンニットは6価の糖アルコールで、構造式は下記である。微生物学の基本であるリン脂質細胞膜の組成のリン脂質を学ぶ際に3価のアルコールのグリセロールが基本となる。これに対してマンニットは炭素がさらに3つ増えた6価のアルコールと理解すればよいだろう。ただし、マンニットは炭素数が6、すなわち、自然に存在する糖の還元体であることから糖アルコールと分類される。
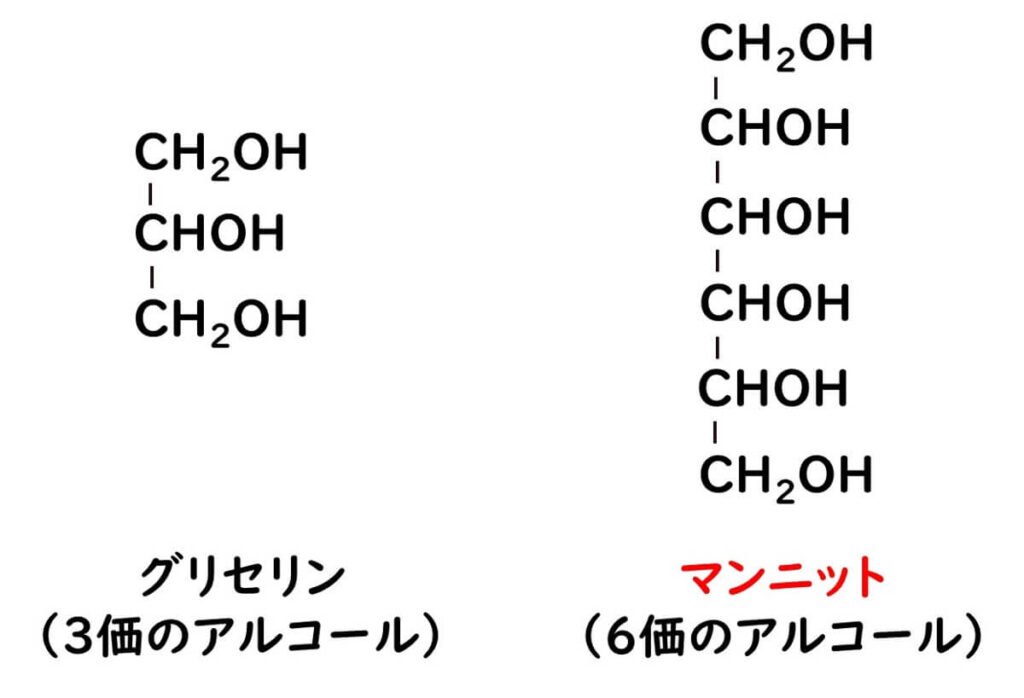
マンニットは自然界に広く存在し、乾燥した海藻や干し柿、きのこなどに含まれる。その水溶性や甘味の性質から、マンニットの異性体であるソルビトール(炭素原子を6つ持つ糖アルコールだが、結合部位が異なる)とともに、カロリーが低く虫歯を引き起こしにくい甘味料として使用されている(指定添加物として、あめ類、チューインガムなどで使用)。清涼感のある甘味で、甘味度は砂糖の55~70%だ。

微生物による利用性
マンニット代謝能力は、微生物によって異なり、この特性を利用して特定の菌種を識別することができる。黄色ブドウ球菌だけではなく、例えばバチルス属なども Bacillus subtilisなど マンニットを炭素源として利用できるものがある(Duanis-Assaf et al.,2020)。
ブドウ球菌の中では、黄色ブドウ球菌はブドウ球菌の中でマンニットを利用する唯一の菌注)であり、この特性を利用することで、他の表皮ブドウ球菌の仲間から黄色ブドウ球菌だけを識別することが可能だ。
注)ただし、後述するようにコアグラーゼ陰性ブドウ球菌の中にもマンニット利用能を持っているものも一部存在するので、マンニット利用性は100%の識別能ではない。また、黄色ブドウ球菌の中でも卵黄反応・マンニット分解ともに陰性株が10%程度存在する。
なぜ黄色ブドウ球菌だけがマンニットを利用する能力を持っているのだろうか?
これは、黄色ブドウ球菌がマンニットの利用性だけではなく、そもそも他の表皮ブドウ球菌たちと異なり、コアグラーゼという血液を凝固する能力を持っていたり、エンテロトキシンを持っていたり、積極的に皮膚の内部まで侵入する性質を持っていることに例えることができる。これをわかりやすく人間社会のサラリーマンに例えて以下に説明してみよう。
コアグラーゼ:ビジネスの「特許技術」
コアグラーゼは、黄色ブドウ球菌が持つ血液を凝固させる酵素で、これを「ビジネスでいう特許技術」と考えることができる。この特許技術を用いることで、黄色ブドウ球菌はヒトの免疫システムの初期攻撃から身を守り、病原性を高めることができる。
エンテロトキシン:「マーケティング戦略」
エンテロトキシンは、黄色ブドウ球菌が産生する毒素で、「マーケティング戦略」として機能する。この戦略によって、黄色ブドウ球菌は他の競争者を圧倒し、病気を引き起こすことでその存在を広め、影響力を増している。
マンニトール利用:「多角化戦略」
さて、マンニトールを利用する能力は、黄色ブドウ球菌が多角化戦略を採用していることを示している。この多角化により、菌は様々な環境でエネルギー源を得る能力を持ち、他のブドウ球菌より一歩先を行くことができる。

このように、黄色ブドウ球菌は、他の表皮ブドウ球菌たちとは一線を画す、非常に独特で攻撃的な性質を持つ。人間社会で言うところの、野心的で能力高いサラリーマンに似ており、常に新しい環境に挑戦し、自身の地位を確立しようと努力している。このような特性が黄色ブドウ球菌を非常に成功した病原体としている。
マンニット食塩培地での黄色ブドウ球菌の識別
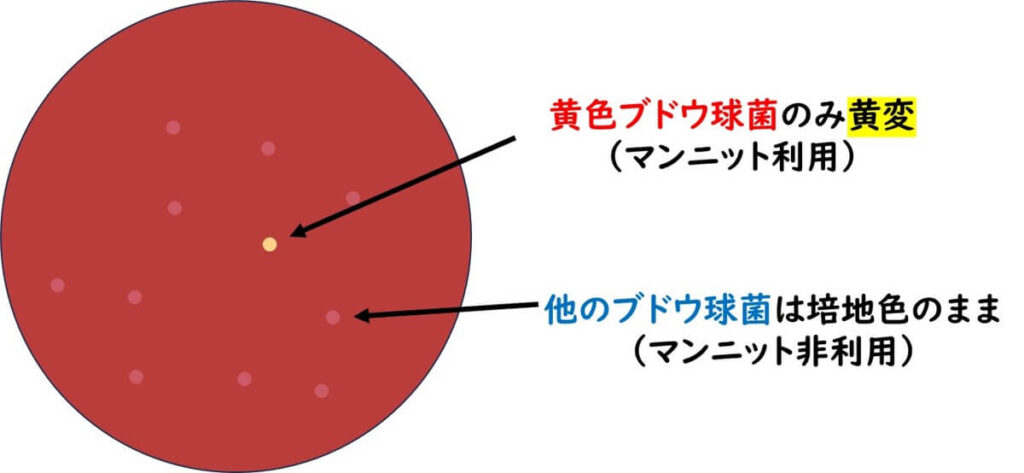
具体的には、マンニット食塩培地にフェノールレッドというpH指示薬を加えることで、黄色ブドウ球菌がマンニットを分解し、培地のpHが変化する。これによりコロニーの周りが酸性となり、黄色く変化する。対照的に、その他の表皮ブドウ球菌はマンニットを利用できないため、コロニーの周囲の色変化は起こらない。このようにして黄色いコロニーの選択を通じて黄色ブドウ球菌だけを識別することができる。
卵黄反応を追加する場合
日本の公定法として採用されてきた黄色ブドウ球菌検査培地では卵黄加マンニット食塩培地の方法が用いられてきた。マンニット食塩培地への卵黄の追加は必須ではないが、卵黄を加えること黄色ブドウ球菌をさらに識別することが可能だ。基本的な同定と分離のためには卵黄を加えないマンニット食塩培地でも十分だが、より詳細な特性評価を目的とする場合には卵黄を加えることが推奨される。

卵黄の添加は黄色ブドウ球菌の同定に有用な2つの性質、レシチン分解とリパーゼ活性を確認するために行われる。
レシチン分解の検査
卵黄にはレシチンという成分が含まれる。これはリン脂質の1種である。主要な成分は、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルイノシトール(PI)、ホスファチジン酸(PA)の代表的な4種類、および他のリン脂質の混合体から成る。
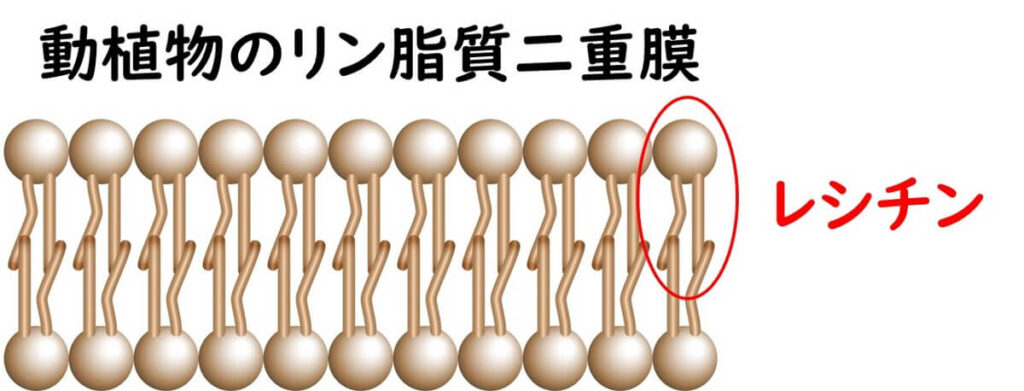
全ての生物の細胞膜はリン脂質二重膜でできているが、細菌の細胞膜と植物や動物の細胞膜では、構成するリン脂質の種類に違いがある。具体的には、レシチンは主に植物や動物の細胞膜に存在するリン脂質で、これに対して細菌の細胞膜には一般的には含まれていない。細菌の細胞膜には、レシチンの代わりホスファチジルグリセロールやカルジオリピンなどのリン脂質が主に含まれている。つまり、黄色ブドウ球菌の産生するレシチナーゼは宿主の細胞膜のリン脂質を分解する能力である。
細胞膜の透過性を変化させ、細胞の内容物が外に漏れ出ることを促進する。この過程は組織の損傷や炎症の引き金となり、感染症の進行に寄与する。黄色ブドウ球菌のような病原菌が宿主の防御機構を破壊し、侵入や拡散を助けるためにこのような酵素を利用することは、その病原性の重要な側面だ。この意味でも黄色ブドウ球菌は他の表皮ブドウ球菌と異なり、宿主に積極的にアタックする貪欲な細菌と言える。

黄色ブドウ球菌レシチン分解酵素(レシチナーゼ)によってレシチンが分解されると、周囲に白濁のハローが形成される。このハローの形成は黄色ブドウ球菌の確認を助け、他の微生物との区別に役立つ。
リパーゼ活性の確認
卵黄は脂質(特に脂肪酸)を豊富に含むため、これを基質とするリパーゼの活性を確認することも可能である。黄色ブドウ球菌はリパーゼを産生し、培地中の脂質を分解する能力がある。この分解作用により、コロニーは真珠様光沢となる。
ただし、リパーゼ活性は黄色ブドウ球菌だけに限らず、他の表皮ブドウ球菌も持つ (Rosenstein and Gotz, 2001)。このため、リパーゼ活性だけをもって黄色ブドウ球菌を識別することは難しい。リパーゼ活性を利用した検査は、特に黄色ブドウ球菌の同定に直接的な指標とするよりも、一般的な表皮ブドウ球菌の生理的特性を評価する一つの方法として用いられる。
Baird-Parker寒天培地
Baird-Parker寒天培地はマンニット食塩培地とは全く異なる原理で構成されている。
選択原理として、塩化リチウム、亜テルル酸カリウム、グリシンの3種の化合物を使用して黄色ブドウ球菌以外の表皮ブドウ球菌の成長を抑制する。マンニット食塩培地では黄色ブドウ球菌以外の表皮ブドウ球菌も検出される場合があるため偽陽性が多い。それに対して、Baird-Parker寒天培地は黄色ブドウ球菌に対する特異性が高く、黄色ブドウ球菌のみを特異的に検出する能力がある。
Baird-Parker寒天培地の選択原理は、必ずしも完全に解明されていない状況である。培地に添加されている3つの化合物(塩化リチウム、亜テルル酸カリウム、グリシン)が他のブドウ球菌の増殖を抑制する具体的なメカニズムは、これらの化合物が黄色ブドウ球菌の選択性を高めることは確かであるが、その詳細な作用メカニズムは完全には明らかではない。このため、培地の選択原理について過度に詳しい理解を求めるのは現実的ではない。したがって、本記事ではこれらのメカニズムについて現状でわかっていることを簡潔に述べた後、むしろ培地がどのような経緯で開発されたかを説明する。この歴史的な流れを追うことにより、Baird-Parker培地の特性がより深く理解されるだろう。
メカニズムの簡単な整理
塩化リチウム
リチウムとナトリウムは共に元素周期表の第1族に属しており、どちらもアルカリ金属だ。これらの元素は化学的な性質が似ている一方で、原子量が異なる。リチウムの原子量は約6.94、ナトリウムの原子量は約22.99である。浸透圧については、同じ質量の溶質を溶解させた場合、原子量が小さいリチウムはより多くのモル数を提供する。このため、リチウムはナトリウムよりも多くのモル数を提供し、その結果として浸透圧をより強く上げることができる。
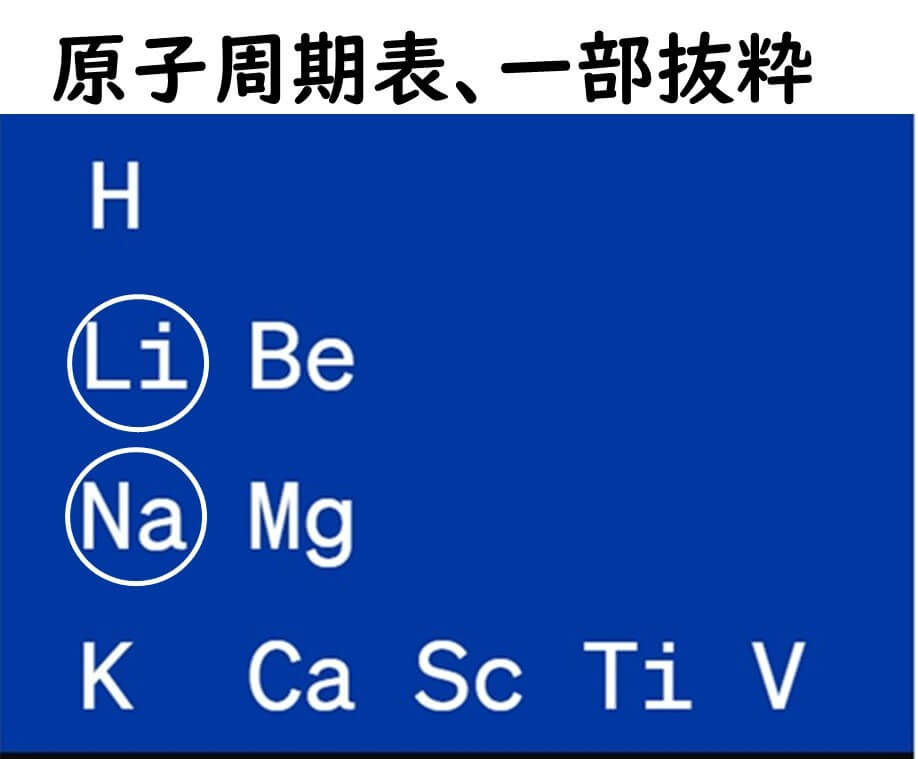
以上がリチウムの一般的な浸透圧との関係で述べたが、Baird-Parker培地に加えられる塩化リチウムの濃度は0.5%に過ぎないため、その浸透圧低下のメカニズムは限定的だ。塩化リチウムの微生物に対する阻害作用には別のメカニズムが考えられるが、その詳細はまだ明確には分かっていない。可能性としては、塩化リチウムが特定の酵素の活動を阻害することや、細胞膜の安定性に影響を及ぼすことなどが考えられるが、これらの効果の具体的な研究は今後の課題である。
亜テルル酸カリウム
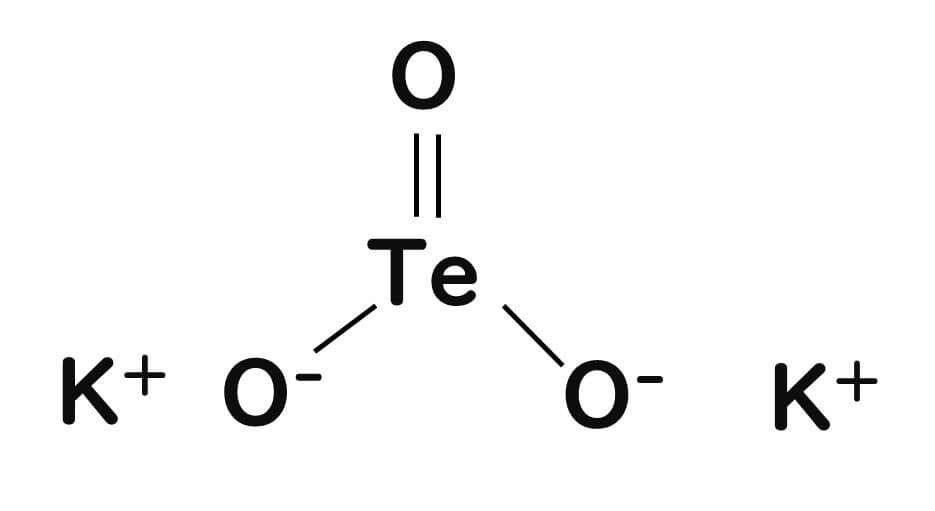
選択剤の作用
テルル酸化物イオンTeO32−は、ほとんどのバクテリアに対して非常に毒性が強く、わずか1μg/mLの濃度で毒性を示す(Taylor et al., 1999)。この数字は、セレン、クロム、鉄、水銀、カドミウム、銅など、他の金属や金属類似物がTeO32−の100倍の濃度で初めて毒性を示すことと比較すると、いかに毒性が強いかがわかる。

このように、テルル酸化物イオンTeO32−の抗菌作用は広く知られているものの、細菌に対する抗菌作用のメカニズムについてはまだほとんど解明されていないのが実態である。現在までいくつかの研究蓄積があるが、いずれも現時点で仮説の域をこえていない(Chasteen et al., 2009)。なおテルル酸化物イオンTeO32に対する耐性菌も多く報告されているが、そのメカニズムも同様にたくさんの研究があるが、解明されていない点では同様である(Chasteen et al., 2009)。
識別作用(コロニーの黒色化)
Klett(1900年)などの研究は、テルル酸イオン(テルル酸アニオン、TeO32−)を添加した微生物で黒色または灰色の不溶性Te0(テルル元素)が生成されることを報告した。その後、この現象はX線回折分析によって証明された(Tucker et al., 1962年)。これは、溶解性のTe(IV)が不溶性の元素形態に生物学的に還元された結果であり、不溶性Te0(テルル元素)の形成を微生物学的試験として利用する興味深い方法につながった。その後、多くの微生物の識別に用いられるようになった。Baird-Parker培地上での黄色ブドウ球菌のコロニーの識別もその一例である。
なお、一般に、ほとんどの微生物はテルル酸イオンをより毒性の低いTe0に還元する能力を共有している。これにより、細胞内に金属Teの黒い沈殿物が生成される。

グリシン
グリシンがなぜ微生物の増殖を抑制するかについては、現時点で考えられているメカニズムは下記の通りである(Hammes et al.1973)。
微生物の細胞はペプチドグリカンの高分子構造で成り立っている。このペプチドグリカンを微生物が合成する際に、微生物の周りに大量のグリシンが存在すると、ペプチドグリカンの前駆体へアミノ酸の取り込みに異常が起きてしまい、アラニンを取り込むべきところをグリシンが取り込まれてしまうと考えられている。アミノ酸前駆体にグリシンが取り込まれてしまうと、ペプチドグリカン合成酵素がペプチドグリカン前駆体との基質親和性を低下させ、しっかりとしたペプチドグリカンを作るのは出来なくなってしまう。
このようにグリシンは抗菌力があるため、現在日本で流通する食品の日持ち向上剤として酢酸ナトリウムとともに最も広く用いられている。
日持ち向上剤としてのグリシンについてのわかりやすい説明は、下記の記事をご覧ください。
有機酸以外の保存料、日持ち向上剤について
Baird-Parker培地の開発の歴史
1950年代:マンニット食塩培地(チャップマン培地)への批判
1940年代に開発されたマンニット食塩培地(チャップマン培地)は、黄色ブドウ球菌の検出に優れた培地として迅速に普及したが、その後の研究で、マンニット食塩培地では、黄色ブドウ球菌だけでなく一部の表皮ブドウ球菌もしばしば混同して識別されてしまうことが明らかになった(Zebovitz et al., 1955)。この発見は、マンニット食塩培地の特異性に対する再評価を促し、その特異性を向上させるための研究が盛んに行われるきっかけとなった。マンニット食塩培地は、表皮ブドウ球菌が発酵できないマンニットを基質として使用しているため、この培地で黄色ブドウ球菌の識別が可能だが、完全な特異性には至っていないという問題が指摘されていた。

1955年:塩化リチウム、亜テルル酸カリウム、グリシンの3種類の化合物により黄色ブドウ球菌以外の 表皮ブドウ球菌を抑制培地
このような議論の中でシカゴ大学のゼボビッツ博士らのグループが、マンニット食塩培地のように黄色ブドウ球菌と他のブドウ球菌をコロニーで識別するのではなく、そもそも他のブドウ球菌が増殖できないような選択培地を開発する事を試みた。すなわち、塩化リチウム、亜テルル酸カリウム、グリシンの3種類の化合物により黄色ブドウ球菌以外の 表皮ブドウ球菌を抑制培地(tellurite-glycine agar)を開発した(Zebovitz et al., 1955)。
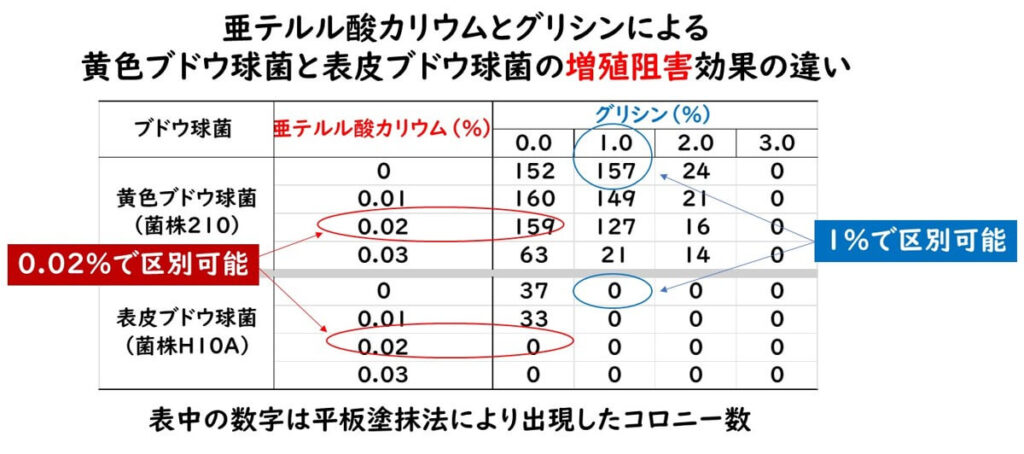
上の表はこの論文(Zebovitz et al., 1955)からのデータの一部を抽出し、ブログ筆者が改めてまとめたものである。
- グリシン1%を追加することによって、黄色ブドウ球菌の増殖は抑制されないがその他の表皮ブドウ球菌は増殖抑制されていることがわかる。
- また亜テルル酸カリウム0.02%でも同様に黄色ブドウ球菌の増殖が抑制されないが、表皮ブドウ球菌は増殖されていることがわかる。
ゼボビッツ博士らはこの他にも、従来から微生物の増殖の抑制メカニズムが知られていた塩化リチウムを加えた培地を開発してこれこそが新しい黄色ブドウ球菌培地であると提唱した。ゼボビッツ博士らが提唱した培地と従来のマンニット食塩培地(Chapman培地)と比較した結果、 マンニット食塩培地では多くの表皮ブドウ球菌の増殖が見られたが、この新しい培地では、黄色ブドウ球菌が特異的に検出できるということを示した(下記表)。
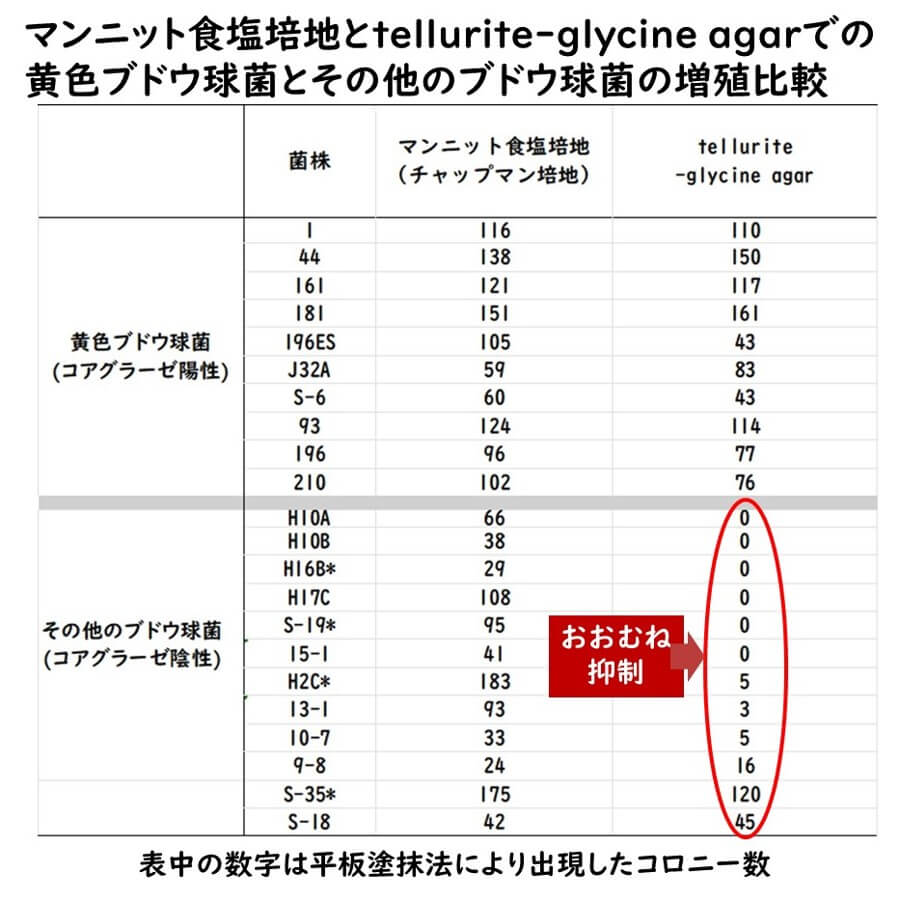
上の表はこの論文(Zebovitz et al., 1955)からのデータの一部を抽出し、ブログ筆者が改めてまとめたものである。
以上の結果から、塩化リチウム、亜テルル酸カリウム、グリシンの3種類添加培地(tellurite-glycine agar)は、マンニット食塩培地より優れた新たな黄色ブドウ球菌選択培地として提唱された(Zebovitz et al., 1955)。

1962年:ベアード・パーカー培地の登場
上に述べたように 1955年に登場した塩化リチウム、亜テルル酸カリウム、グリシンの3種類の化合物により黄色ブドウ球菌以外の 表皮ブドウ球菌を抑制するという全く新しい原理に基づいたにいゼボビッツ博士の開発した培地は画期的ではあった。
しかし、Baird-Parker(1962)らが追試を行った結果、確かに表皮ブドウ球菌の増殖は抑制されるが、黄色ブドウ球菌も同時に阻害されてしまっているため、過小評価されていると指摘した。

そこでBaird-Parker(1962)は、この問題点を解消するためにピルビン酸を加え、さらに判別法として卵黄を加えるということを思いついた。これがすなわちBaird-Parker培地の誕生だ。
ピルビン酸はグルコース代謝の解糖系の中間代謝産物である。細胞がストレスや損傷を受けた場合、ピルビン酸の供給が増加すると、エネルギー産生の効率が向上し、細胞修復や生存率の向上に寄与する。このため、ピルビン酸は培地に添加されることがあり、特定の微生物を効果的に回復させるのに役立つ。
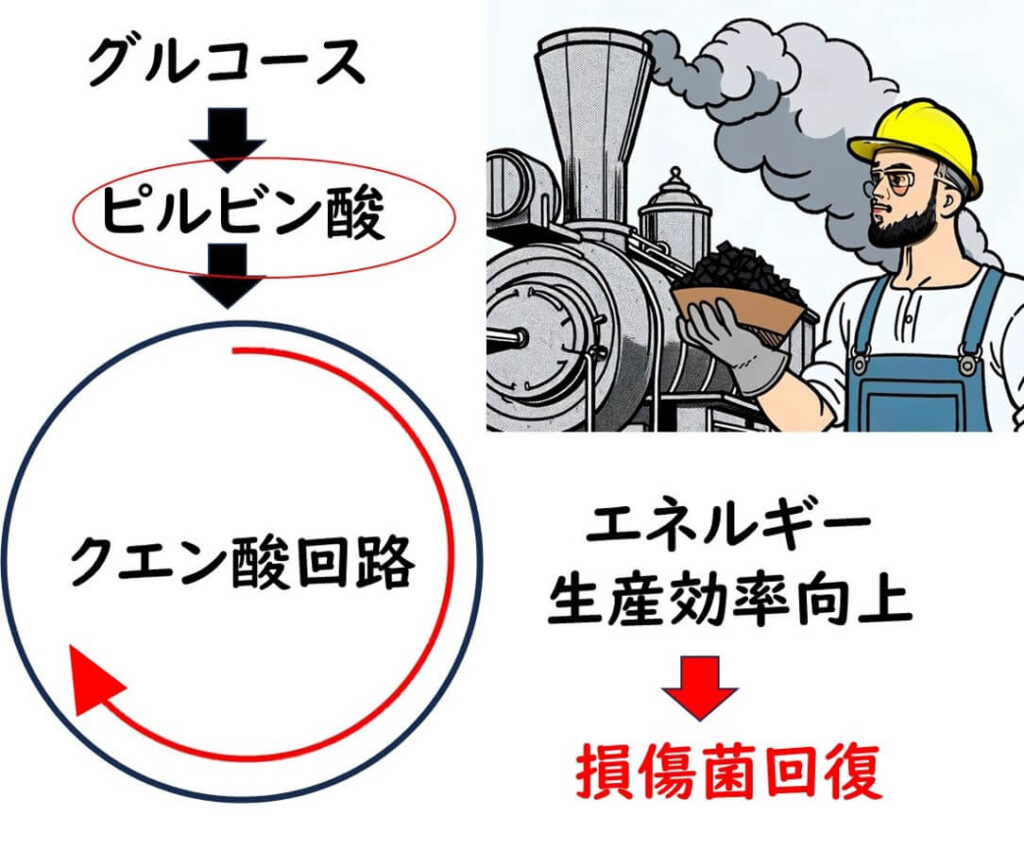
この培地の登場により、ゼボビッツ博士らが開発したTellurite-Glycine Agarによる黄色ブドウ球菌の選択性に加えて、黄色ブドウ球菌の増殖が過度に抑制されない(偽陰性にならない)ような回復措置を加えた培地が出来上がった。

以上の経緯で、黄色ブドウ球菌検出培地としてBaird-Parkerの名前を呈した培地が現在まで知られることになった。
以上の歴史を見れば分かるように、Baird-Parker培地の背景には、その数年前のシカゴ大学のゼボビッツ博士らのグループの功績もかなり大きい。培地に一人の研究者の名前しか歴史は残らないので仕方がないが、改めて、科学研究は多くの研究者による総合的な成果であることがこの経緯からわかる。
下記にBaird-Parker培地組成を示す。
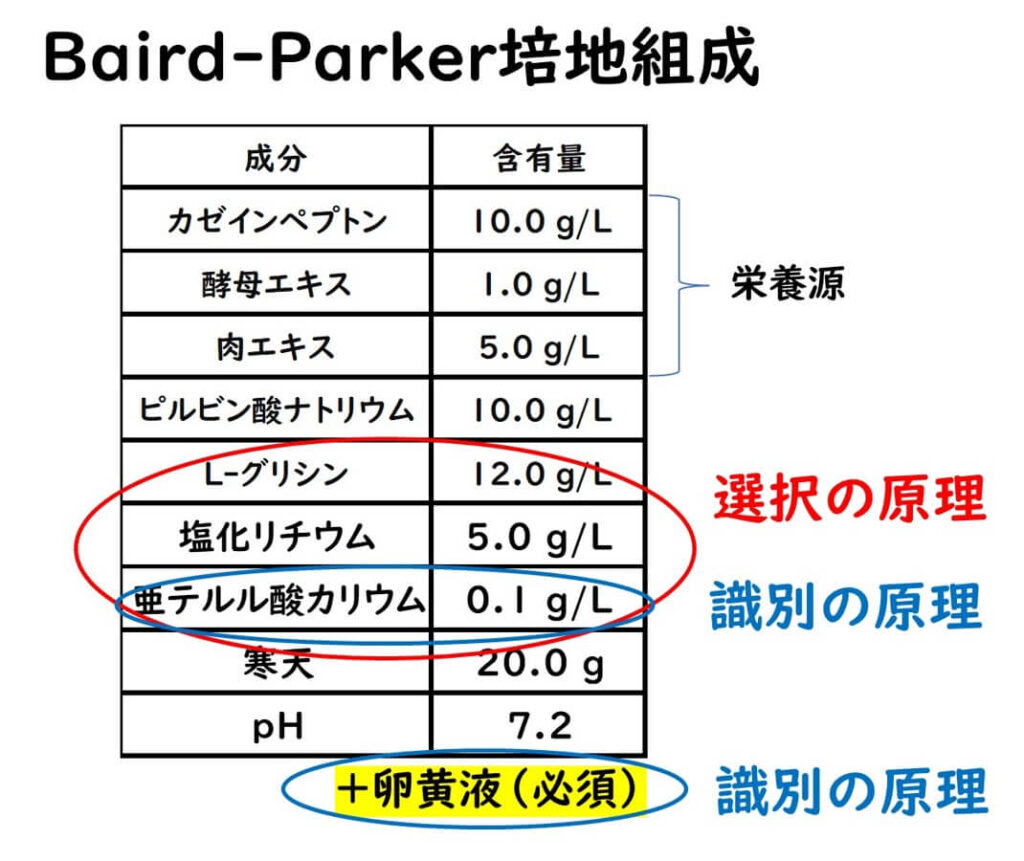
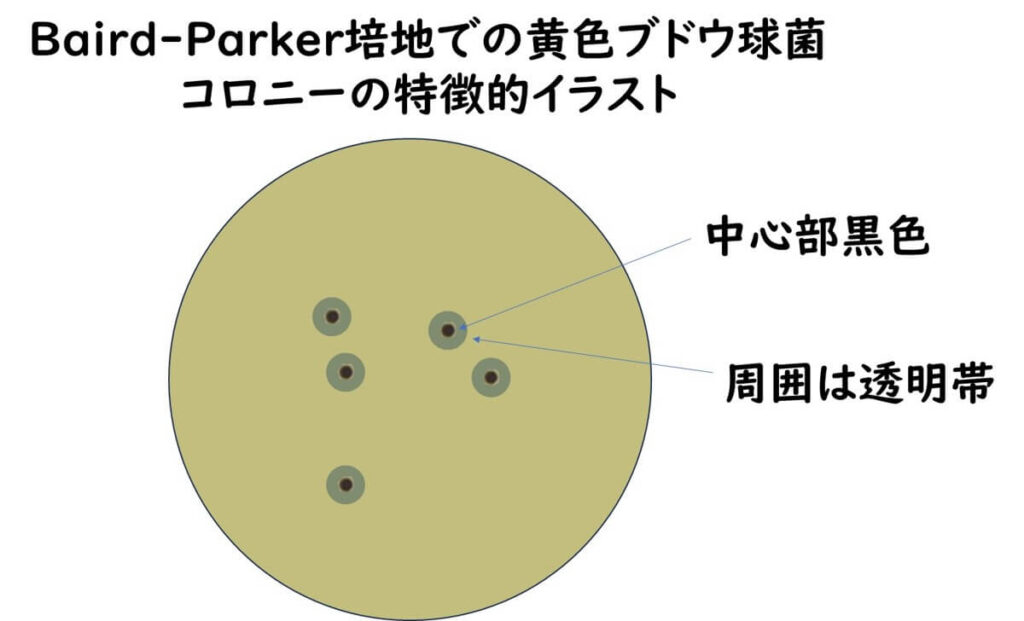
なお、 Baird-Parker培地における卵黄の効果は、上述した卵黄加えマンニット食塩培地での欄を添加と同じ効果である。最終的にはBaird-Parker培地での黄色ブドウ球菌のコロニーは、黒く光沢がある中心部(亜テルル酸イオンの還元による)を持ち、その周囲は透明帯(卵黄反応による)をもつ。
まとめ
本記事では、黄色ブドウ球菌検出用培地として代表的なマンニット食塩培地とBaird-Parker培地の原理について解説を加えた。特にBaird-Parker培地については、その開発の歴史を振り返ることによってこの培地の性能を解説することにした。
2015年までは国際的にはBaird-Parker培地であり、日本ではマンニット食塩培地のみが公定法であったため、国際的な整合性が取れない状態が続いていた。現在は日本でもBaird-Parker培地が公定法に採用され、国際的な整合性が取れている。卵黄加マンニット食塩培地は現在でも日本では代替法として位置づけられているが、国際貿易等ではBaird-Parker培地を使用する方が、国際的整合性という点ではスムーズである。
いずれにせよ、培地の原理については、その原理が未解明である部分も含め、培地成分の読解力を身につけておくことにより、培地上に出現したコロニーやその結果の判断に迷うことも少なくなるだろう。