EUでは食品中の大腸菌の検査に、酵素基質培地法が一般的に採用されている。日本の食品業界でもこの方法に注目が集まり、多くの企業が自主検査に導入している。では、培地の選び方や培養温度は?本記事では、国際的に認知されたISO標準法に基づく大腸菌の検査手法を詳しく解説する。

ISO 16649 (β-グルクロニダーゼ陽性大腸菌の計数のための水平法)
ISO 16649 「β-グルクロニダーゼ陽性大腸菌の計数のための水平法注)」、次の3方法で構成されている。ユーザーは、いずれの方法も選択できる。
注)"水平法"(horizontal method)はISOなどの国際標準化機構で用いられる用語で、特定の試料や環境に限定されず、幅広い試料や環境に適用可能な方法を指す。これに対して、特定の試料や環境専用の方法は"垂直法"(vertical method)と呼ばれることがる。
- ISO 16649-1:メンブレンと酵素基質( β-D-グルクロニダーゼ)培地を使用した 44 °C でのコロニーカウント手法(極度な損傷菌検出用)
- ISO 16649-2:酵素基質( β-D-グルクロニダーゼ)培地を使用した 44 °C でのコロニーカウント手法
- ISO 16649-3:酵素基質( β-D-グルクロニダーゼ)培地を使用した検出およびMPN(最確数)法
上記の方法のうち、❶は極度の損傷菌の回復を目的とし、メンブレン上で回復培地を使用して培養するものである。❸は複数の液体培地を用いた、いわゆるMPN(最確数)法を指す。❶および❸は、簡便性の観点から、食品企業が自主検査において日常的に使用する機会は❷ほど多くはないだろう。本記事では、実用性の観点から食品企業の品質管理者が最も利用する可能性がある❷に焦点を絞り、解説する。

ISO 16649-2: 酵素基質培地を使用した 44 °C でのコロニーカウント手法
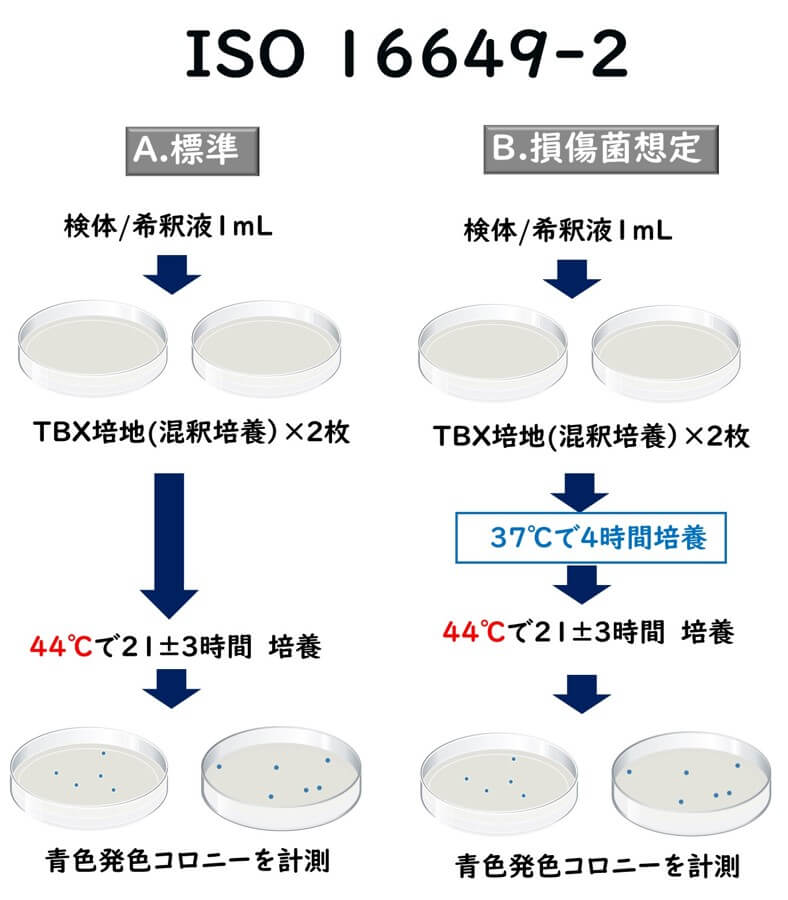
ISO 16649-2:2001 (2023年最新版)の手順について述べる。
手順概要
- 滅菌シャーレに試験試料(液体の場合)1mL、その他の製品の場 合は初期希釈液(10倍希釈液)1mLを移す。
- 各希釈液につき2枚のプレートに接種する(必要であれば、希釈ごとに新しい滅菌ピペットを用いて、さらに10倍希釈を繰り返す)。
- ウォーターバスで 44℃から 47℃に冷却した トリプトン胆汁酸 X-グルクロニド(TBX)培地 (培地成分後述)を各シャーレに約 15 ml 注ぐ(混釈培養)。シャーレに接種用菌液を分配してから培地を注ぐまでの時間は 15 分以内とする。
- シャーレを涼しい水平な場所に置き、試料液と培地を注意深く混ぜて固まらせる。
- 接種したシャーレを底が上になるように倒立させ、44℃に設定した培養器で 21 ± 3 時間培養する。
- ただし、損傷細胞注1)の存在が疑われる場合は、まず、37℃で4時間培養する。その後、培養温度を44℃に上げ、21 ± 3 時間培養する。
- 培養後、定型 CFU が 150 以下、かつ(定型と非定型の)合計 CFU が 300 以下の各プレートの-グルクロニダーゼ陽性大腸菌の定型 CFU を計数する注2)
注1)損傷細胞:食品微生物検査における損傷細胞とは、物理的または化学的なダメージを受けたが、まだ生存している微生物を指す。食品中には、加熱、pH、水分活性、保存料などのさまざまな抗菌処理が施されているため、微生物が損傷細胞として存在する可能性が高まる。これらの損傷細胞は生きている可能性があるが、特に選択剤を含む培地で直接培養すると、死滅したと判定されるリスクがある。
注2)ISO 16649-2では計測された大腸菌のコロニー数から試料1g当たりの大腸菌数の算出の定量的術式も示されている、本稿では、検出に焦点を絞り、定量の術式の説明は省略する。
培地成分読解
トリプトン胆汁酸 X-グルクロニド(TBX)培地の成分は下記のとおりである。培地組成はいたってシンプルである。

栄養
カゼイン酵素消化物だけが栄養として含まれている。
選択性
胆汁酸塩はグラム陽性細菌の増殖を阻害する。言い換えれば、この培地ではグラム陰性菌のすべてはコロニーを形成することができる。
胆汁酸塩がなぜ、グラム陽性菌の増殖を阻害するのかについての、わかりやすい解説は下記の記事をご覧ください。
識別原理
発色性の 5-ブロモ-4-クロロ-3-インドリル-β-D-グルクロニド(X-グルクロニド)が添加されているため、β-グルコロニダーゼをもっているグラム陰性菌、すなわち、大腸菌のみが発色基質を分解し、その分解産物により、青/緑のコロニーになる。
なお、酵素基質培地による大腸菌識別の原理に関するわかりやすい説明は、本ブログ別記事にまとめているので、下記をご覧いただきたい。
ここでは、ごく簡単に原理をのべると、大腸菌が持つ特有の酵素であるβ-グルコロニダーゼを検出するために、培地に5-ブロモ-4-クロロ-3-インドリル-β-D-グルクロニド(X-グルクロニド)を添加し、その分解産物としての発色を確認することで、大腸菌を識別できるわけだ。
培養温度と時間について
44℃±1℃(45°Cは超えてはならない)で18時間から24時間培養する。温度を44℃に設定する理由は、糞便系大腸菌群の温度設定と同じ理由であり、大腸菌以外の大腸菌群を含めたほとんどのグラム陰性菌がこのような高温で増殖できないという性質を利用している。
糞便系大腸菌群のわかりやすい説明は下記の本ブログ記事をご覧ください。
ただし、損傷菌の存在の可能性がある場合は、いきなり44°C培養では、大腸菌も増殖できなる可能性があるので、まずは、選択圧のない37°Cで4時間培養し、損傷細胞の回復をまってから、44°C培養へ移行する。

英国の公定法: 損傷菌を前提に
ISO 16649-2でも損傷菌の検出プロトコルのオプションもあるので、食品会社の日常検査では、ISO 16649-2が最も、簡便で実用的である。
ちなみに、英国では、ISO 16649-2のうち、損傷菌のプロトコルのみを大腸菌検査の公定法に設定している。食品にストレス細菌がいるかいないかの判断は各事業者が判断しにくいので、すべてストレス細胞であると仮定して、ISO 16649-2のストレス前培養方式ですべての食品や環境サンプルの統一公定法に設定しているわけだ。
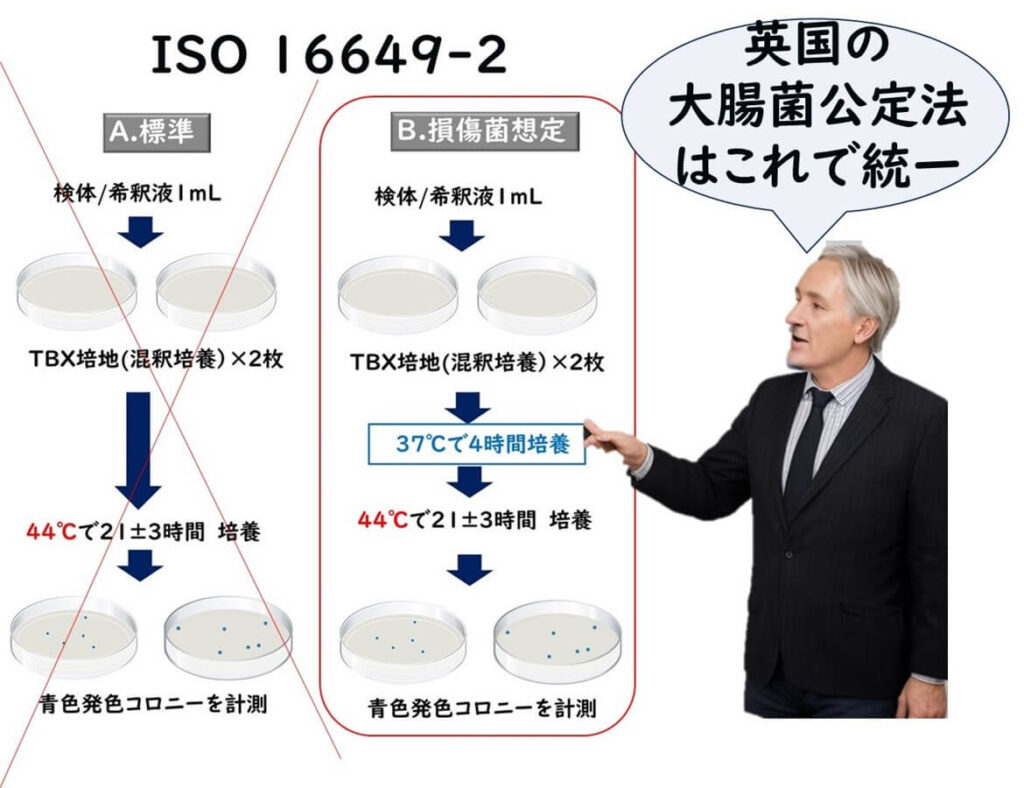
なお、英国公定法では、発色コロニーでのみ大腸菌を判別し、その後の確認試験は行わない。44℃のTBX寒天培地で生育し、ß-グルクロニダーゼ反応が陽性(青いコロニー)の菌は大腸菌と考えられるので、確認試験は不要であるとしている。
ブログ執筆者の個人的見解でも、このような英国の考え方が、実用的に個別に判断を迷うこともないので、もっともシンプルで実用的であると思う。
まとめ
本記事では、EUで採用されている大腸菌検査の基準法であるISO法に焦点を当て、特に混釈法によるコロニーカウント法(ISO 16649-2)について解説した。
ISO法の特徴は、培養温度が44°Cである点にある。この方法は大腸菌を特定して検出するもので、44℃という高温は、他の大腸菌群やグラム陰性菌の増殖を抑制する目的がある。使用されているTBX培地の成分からは、BX培地の選択剤が胆汁酸のみである。これは、基本的に全てのグラム陰性菌が増殖可能であり、培地成分上で大腸菌だけを増殖させる特定の選択剤は含まれていないことを意味する。このため、ISO法では、培養温度を44℃と少し高めに設定し、大腸菌の選択的増殖を図る考え方が伺える。
一方、市販の酵素基質培地は、培養温度が44°Cではなく、37°Cに設定されているものも多い。これは、大腸菌群と他の菌の同時判別(大腸菌群は44°Cでは増殖困難なものが多い)を可能にするために培地が設計されていると考えられる。しかし、大腸菌検出に関しては、37°Cでの培養でも、AOACなどの国際認証機関においてISO法(44℃培養)との同等性が証明されている場合は、これは問題ではない。
しかし、酵素基質培地を使用して大腸菌の存在だけを確認したい場合、これら市販培地の参照原典であるISO法の理解は重要である。ISO法を理解することで、結果の解釈と応用範囲が広がるだろう。


